مول چیست؟ جرم مولی چیست؟ و چگونه محاسبه میشود؟ برای انجام محاسبات مولی، درک مفهوم مول و جرم مولی اهمیت زیادی دارد. در این مقاله با ما همراه باشید تا مفهوم مول، عدد آووگادرو و جرم مولی را یاد بگیرید و با چگونگی تبدیل مول به گرم یا تعداد ذرات و یا نحوه تبدیل گرم به تعداد ذره سازنده ماده،آشنا شوید. 
مول (mole) یکی از هفت واحد اساسی SI است و برای اندازه گیری ماده بخصوص ذرات در مقیاس اتمی مانند اتم ها ، مولکول ها ، یون ها و رادیکال ها و همچنین ذرات زیر اتمی مانند الکترون ها و پروتون ها استفاده می شود مورد استفاده قرار میگیرد.. به عنوان مثال، وقتی می گوییم یک مول سدیم کلرید(NaCl) در ارلن وجود دارد ، یعنی تقریباً 6.022 × 1023 مولکول NaCl در ارلن وجود دارد. برای اولین بار در سال 1894 ویلهلم استوالد شیمی دان آلمانی واحد Mol را از کلمه آلمانی Molekülu استخراج کرد.
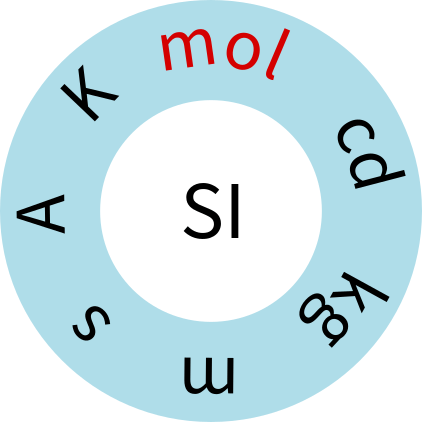
شکل 1. هفت واحد SI
مول چیست؟
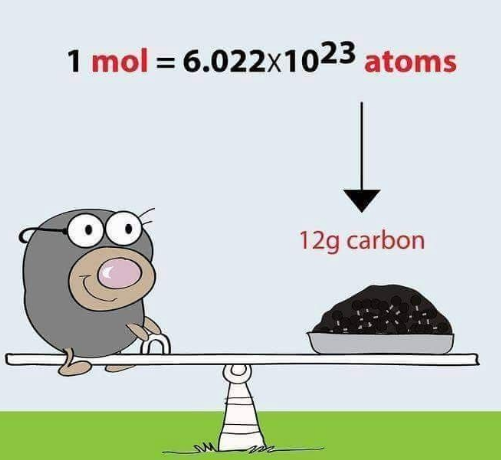
مول به صورت تعداد اتمهایی که دقیقاً در 12 گرم از کربن 12 وجود دارد، تعریف میشود. این عدد برابر 6.022×1023 است و به نام عدد آووگادرو (Avogadro) شناخته میشود.
چرا از مول استفاده میکنیم؟
مول به عنوان واحد مقدار ماده مورد استفاده قرار میگیرد. ولی چرا با وجود اینکه میتوانیم از کیلوگرم برای اندازه گیری جرم یک ماده استفاده کنیم، بایستی واحدی برای اندازه گیری مقدار ماده داشته باشیم؟ پاسخ ، واکنشهای شیمیایی است. در واکنش های شیمیایی، تعداد اتم ها و مولکول ها حائز اهمیت است و جرم اهمیتی ندارد. در واقع استوکیومتری واکنش بر اساس تعداد مول واکنش دهنده ها و محصولات بیان میشود. به عنوان مثال واکنش خنثی سازی زیر را در نظر بگیرید.
![]()
- در واکنش خنثی سازی ، یک مولکول هیدروکسید سدیم (NaOH) با یک مولکول اسید کلریدریک (HCl) واکنش میدهد و یک مولکول کلرید سدیم (NaCl) و یک مولکول آب (H2O) تشکیل می شود. بنابراین ، تعداد مولکول های شرکت کننده واکنش را کنترل میکنند، نه جرم مواد.
- اتم ها و مولکول ها بسیار کوچک هستند و تعداد بسیاری از آنها در هر نمونه ماکروسکوپی وجود دارد و توزین آنها با ترازوهای معمولی امکان پذیر نیست. شیمی دانان با یک اتم یا یک مولکول سر و کار ندارند و نظارت بر واکنش های مربوط به یک اتم یا یک مولکول نیز عملی نیست. بنابراین از واحد مول مورد استفاده میشود. یک مول تقریباً 6.022 × 1023 تعداد ذره را نشان می دهد. این عدد بسیار بزرگ است و فقط برای ذرات در مقیاس اتمی استفاده میشود
- در واکنش خنثی شدن سدیم کلرید، یک مول هیدروکسید (≈ 40 g) با یک مول اسید کلریدریک (≈ 36.5 g) واکنش می دهد و یک مول کلرید سدیم (≈ 58.5 g) و یک مول آب (≈ 18 g) تشکیل می شود. در واقع واحد مول پل ارتباطی بین دنیای اتمی و جهان ماکروسکوپی است و ما می توانیم توسط جرم مولی ، مول و گرم را به یکدیگر تبدیل کنیم. مفهوم جرم مولی در ادامه این مقاله توضیح داده شده است.

شکل 2. یک مول NaCl معادل 58.5 گرم است.
عدد آووگادرو و ثابت آووگادرو (Avogadro’s Constant) چیست؟
عدد آووگادرو به عدد 6.022 140 76 × 1023 گفته می شود. این عدد به افتخار کاشف قانون آوگادرو Amedeo Avogadro ، نامگذاری شده است. اگر به عدد آووگادرو واحد mol −1 اختصاص دهیم به صورت ثابت آووگادرو نامیده می شود و با NA مشخص می شود.. معادله زیر رابطه بین مول و عدد آوو را توصیف می کند:
![]()
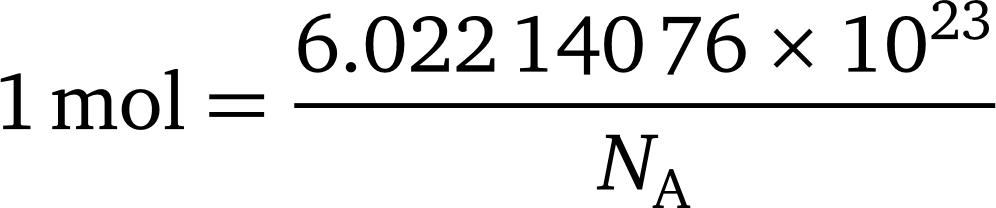
تعریف جرم مولی (Molar Mass)
جرم مولی یک ماده برابر جرم یک مول از اجزای بنیادی آن( اتمها، مولکولها یا واحدهای فرمولی) میباشد. واحد جرم مولی به صورت گرم بر مول(g/mol) بیان میشود. چون عناصر و مولکول های مختلف جرم های مختلف دارند، ا مول از ترکیبات مختلف نیز دارای جرم های متفاوتی هستند. شکل زیر این موضوع را به وضوح نشان میدهد:

شکل 3. جرم مولی مواد شیمیایی رایج (از چپ به راست: اکسید جیوه ، 216 g mol−1؛ ساکارز ، 342 g mol−1؛ گوگرد ، 32 g mol−1؛ سولفات مس 5 آبه، 250 g mol−1 ؛ سدیم کلرید 58.5 g mol−1 ؛ مس، 63.5 g mol−1.
جرم مولی اتمها، مولکول ها و ترکیبات یونی را چگونه محاسبه کنیم؟
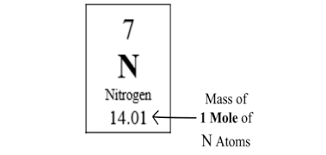
برای محاسبه جرم مولی عناصر و ترکیبات مختلف، از جدول تناوبی کمک گرفته و به صورت زیر عمل کنیم:
چگونگی تعیین جرم مولی عناصر
جرم مولی یک عنصر را بایستی با توجه به اینکه عنصر در طبیعت به صورت اتمهای مجزا و یا مولکولی وجود دارد، معلوم کرد:
- جرم مولی عناصری که به صورت اتم های مجزا وجود دارند، برابر جرم اتمی درج شده در جدول تناوبی است. ولی در واحد “گرم بر مول” بیان میشود. به عنوان مثال جرم یک اتم هیدروژن برابر 1.0079 u و جرم مولی آن برابر 1.0079 g/mol است.
- برای محاسبه جرم مولی عناصر مولکولی، ابتدا بایستی فرمول مولکولی آنها را بدانید و سپس جرم مولی را با توجه به فرمول مولکولی بدست آورید. به عنوان مثال هیدروژن در طبیعت به صورت مولکولی H2 وجود دارد و جرم مولکولی H2 به صورت مجموع جرم دو اتم هیدروژن سازنده به صورت 1.0079 + 1.0079 = 2.0158 u محاسبه میشود و جرم مولی آن برابر 2.0158g/mol است.
چگونگی تعیین جرم مولی ترکیبات
- مولکولها از کنارهم قرار گرفتن اتمها تشکیل میشوند. اگر وزن اتمی همه اتم های تشکیل دهنده یک مولکول را جمع کنید، وزن مولکولی بدست میآید. در بررسی ترکیبات یونی مانند NaCl و KBr در حالت جام،د از اصطلاح وزن فرمولی به جای وزن مولکولی استفاده می شود زیرا ترکیبات یونی آرایه ای سه بعدی از ذرات باردار هستند و مانند مولکولهایی که توسط پیوندهای کووالانسی تشکیل می شوند مولکول های مجزا تشکیل نمی دهند. وزن فرمولی یک ترکیب یونی از مجموع وزنهای اتمی آن مطابق فرمول تجربی آن محاسبه می شود.
- برای محاسبه وزن مولکوی و وزن فرمولی باید جرم تمام اتمهای تشکیل دهنده را با هم جمع کنیم. به عنوان مثال وزن مولکولی(MW) مولکول آب از مجموع جرم اتم های تشکیل دهنده یعنی دو اتم هیدوژن و یک اتم اکسیژن محاسبه میشود:
![]()
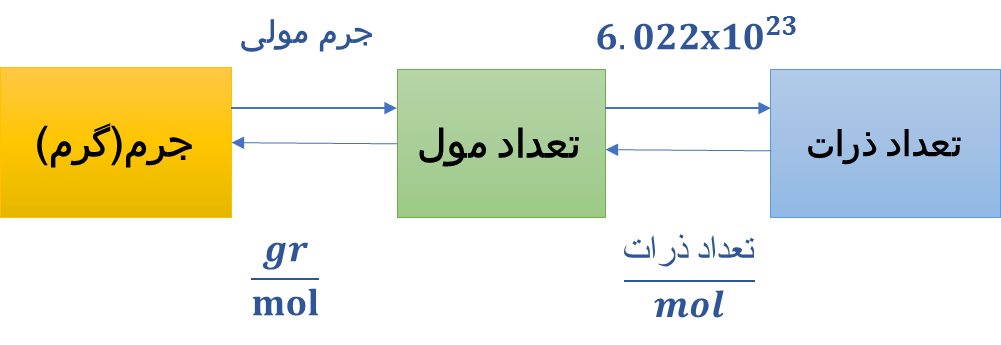
چگونگی تبدیل مول، جرم و تعداد اجزای بنیادی به یکدیگر
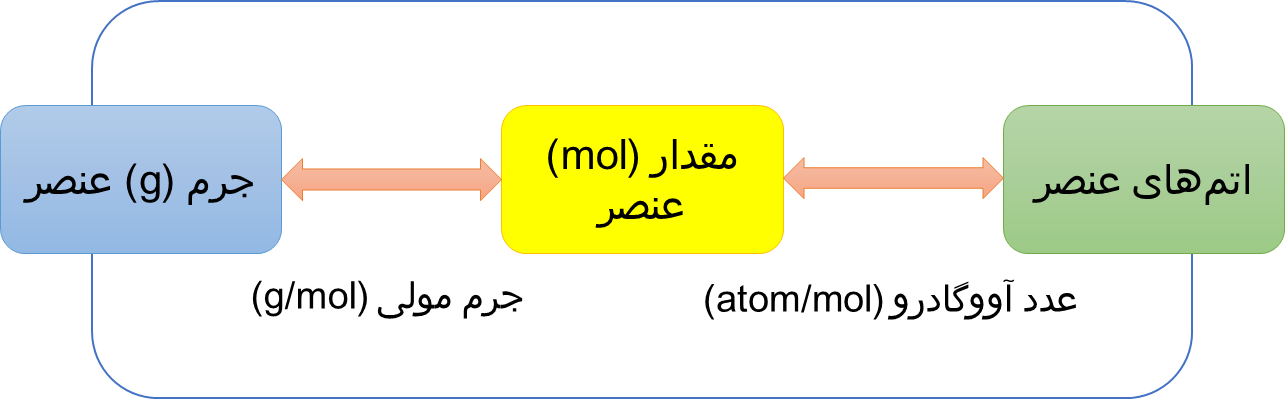
شکل 4.خلاصه ای از ارتباط جرم، مول و تعداد عناصر
یکی از دلایلی که مول برای کار آزمایشگاهی بسیار کارآمد و مفید میباشد، این است که در صورتی که تعداد مول ماده را بدانید به راحتی میتوانید جرم و یا تعداد اجزای بنیادی ماده را در نمونه محاسبه کنید، و یا برعکس، اگر شما جرم و یا تعداد اجزای بنیادی ماده را بدانید، میتوانید تعداد مولها را محاسبه نمائید. بنابر این با داشتن یکی از مقدارهای داده شده، می توان دیگر مقادیر را با استفاده از ضرایب تبدیل بین این واحدها بدست آورد.
چگونگی تبدیل مول و گرم
جرم مولی، ارتباط بین یک مول هر ماده و جرم آن بر حسب گرم را بیان میکند. بنابراین می توان از جرم مولی به عنوان عامل تبدیل مول به جرم ( و یا معکوس آن ، تبدیل مول به جرم) استفاده کرد.

شکل 5. چگونگی تبدیل مول و گرم
به عنوان مثال :
- وقتی میگوییم 1 مول آلومنیم دارای جرم 26.98grاست، می توان آن را به صورت ریاضی بیان کرد:
mol Al = 26.98 g Al
- اگر دو طرف این عبارت را به صورت کسری بنویسیم، دو ضریب تبدیل به دست خواهیم آورد:
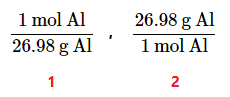
- از ضریب تبدیل اول برای تبدیل جرم به مول و از ضریب تبدیل دوم میتوان برای تبدیل مول به جرم استفاده کرد. با استفاده از ضرایب تبدیل میتوان مسائلی را که به نظر میرسند را به راحتی حل کرد.
به نحوه انجام محاسبات زیر توجه کنید:
چگونه میتوان جرم مربوط به 0.5 mol هیدروژن مولکولی (H2) را به دست آورد؟
- ابتدا بایستی جرم مولی مولکول H2 را از جمع جرم دو اتم هیدروژن بدست آوریم. جرم مولی H2 برابر 2.06 گرم بدست میآید. این عدد نشان دهنده این است که هر مول از مولکول هیدروژن 2.06 گرم وزن دارد:
(1mol H2 = 2.06 gr H2)
- بر اساس این رابطه، ضریب تبدیل های آن به صورت زیر نوشته می شود:
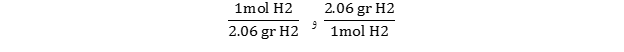
- اکنون باید تصمیم بگیریم از کدام عامل تبدیل استفاده کنیم. از آنجا که در حال صورت مسئله واحد مول داده شده، باید از ضریب تبدیلی استفاده کرد که واحد مول را حذف کرده و واحد جرم باقی بماند. بنابراین ، بایستی از ضریب تبدیل استفاده کنیم.
![]()
- حال مقدار مول داده شده را در ضریب تبدیل ضرب میکنیم:
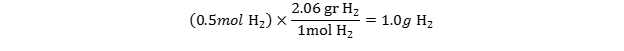
چند مول کربن در 5 گرم کربن وجود دارد؟
با نگاهی به جدول تناوبی متوجه میشویم که جرم اتمی C برابر 12.01 است. از آنجایی که جرم یک مول اتم برابر با وزن اتمی آن است، میتوانیم گفت که ا مول اتم کربن برابر 12.01 گرم وزن دارد و ضریب تبدیل آن برابر است با: 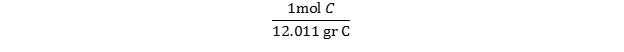 از آنجا که 5 گرم کربن داریم ، به سادگی باید یک تبدیل واحد خواهیم داشت:
از آنجا که 5 گرم کربن داریم ، به سادگی باید یک تبدیل واحد خواهیم داشت:
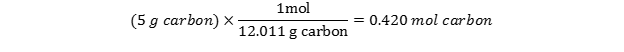
چگونگی تبدیل مول به تعداد ذرات
ازعدد آووگادرو میتوان به عنوان ضریب تبدیل برای تبدیل تعداد ذرات و تعداد مول یا جرم ماده استفاده کرد. همانطوری که میدانید هر مول ذره شامل 6.0226.022×1023 ذره است.

شکل 6. چگونگی تبدیل مول به تعداد ذرات
به مثالهای زیر توجه کنید:
در 3.42 مول گاز H2 چند مولکول H2 وجود دارد؟
- ابتدا بایستی رابطه بین تعداد مول و تعداد ذرات مولکول هیدروژن را بنویسید:
1mol H2 = 6.0226.022×1023 molecules of H2
- سپس ضرایب تبدیل را مشخص کنید:
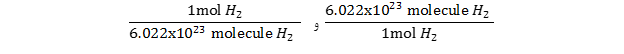
- در مرحله بعد، معلومات و مجهولات را مشخص کرده و ضریب تبدیل را طوری قرار دهید تا واحدهای داده شده در صورت مساله حذف شده و فقط واحدهای که می خواهیم پیدا کنیم باقی بماند. با یک تبدیل واحد خواهیم داشت:
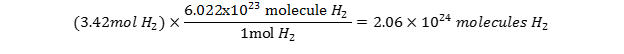
چگونگی تبدیل جرم به تعداد ذرات
اگر جرم نمونه ای دارید و میخواهید تعداد ذرات موجود در نمونه را محاسبه کنید بایستی ابتدا جرم را به مول تبدیل کنید و سپس با استفاده از عدد آووگادرو ، تعداد مول را به تعداد مولکول تبدیل کنید.
شکل 7. چگونگی تبدیل جرم به تعداد ذرات
به عنوان مثال ، اگر میخواهید بدانید که در 6.022 gr گاز H2 چند مولکول H2 وجود دارد، بایستی به صورت زیر عمل کنید:
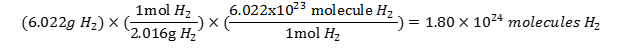
برای حل مسائل مربوط به ارتباط بین جرم-مول-تعداد ذرات نکات زیر را به خاطر بسپارید:
- برای تبدیل بین مقدار ماده (مول) و جرم (g) از جرم مولی (g/mol) استفاده کنید.
- برای تبدیل بین مقدار ماده (مول) و تعداد اجزای بنیادی از عدد آووگادرو () استفاده کنید.
- جرم و تعداد اجزای بنیادی به طور مستقیم با یکدیگر ارتباط ندارند و برای تبدیل جرم و تعداد اجزای بنیادی بایستی ابتدا آن ها را به مول تبدیل کنید.
لطفا سوالات و نظرات خود را با ما در میان بگذارید. مطمئن هستیم که نظرات شما برای ما و سایر افراد مفید خواهد بود.



سلام وقتتون بخیر.خیلی عالی بود سایتتون خیلی به دردم خورد واقعا.یه ایراد هم داشتم پیام دادم اصن انتظار هم نداشتم جواب بدن ولی جواب دادن و راهنماییم کردن
متشکرم.خوشحالم که براتون مفید بوده.
باسلام وقت بخیر لطفا این مسِله رو حل کنید برام ممنونم همه مراحل رو می دونم فقط عدد 3ازکجا میاد لطفا راهنماییم کنید ممنونم.
نه دهم گرم آب چند اتم دارد ؟
اول گرم رو به مول تبدیل کن و بعد مول رو به تعداد اتم یا مولکول h2o
می دانیم 18 گرم آب به تعداد عدد آووگادرو مولکول دارد پس با یک تناسب ساده بگویید وقتی 18 گرم آب به تعداد عدد آووگادرو مولکول دارد.0.9 گرم چند تا دارد؟
لطفا سوال خود را در باکس پاسخگویی مطرح بفرمایید.
پ جرم مولی به مول کو؟؟؟؟؟؟؟؟؟؟؟😐😐😐😐😐😐😐😐😐
ممنون خیلی خوب بود
سلام لطفا نحوه تبدیل مول به مول رو هم بگین ممنون
تبدیل مقدار مول ترکیبات مختلف با توجه به استوکیومتری واکنش مورد نظر امکان پذیر است.
عالی
موفق باشید.
تبدیل مول به میلی مول رو میفرمایید 🙏
با سلام. هر مول برابر ۱۰۰۰ میلی مول هست.
سلام من آزمونی میخوام انجام بدم که به 99.5میلی گرم فروسانید سدیم 10 ابه نیاز داره اگر بخوام به جای فروسانید سدیم از فروسانید پتاسیم استفاده کنم چند گرم باید بردارم
ممنون میشم راهنماییم کنید؟
با سلام
اگر آزمون برمبنای مول است، ابتدا حساب کنید که 99.5میلی گرم فروسانید سدیم معادل چند مول است و سپس ببینید که آن مقدار مول برابر چندگرم از فروسیانید پتاسیم است
برای انجام این محاسبات هم به وزن مولکولی فروسیانید سدیم و فروسیانید پتاسیم نیاز دارید
این مسعله میخاستم حل شه
در ۷.۱ گرم گاز کلر چند مولکول وجود دارد با راه حل کامل
هر مول از گاز گلر برابر 71 گرم است. در هر مول و یا به عبارتی در هر 71 گرم از گاز کلر به تعداد عدد آووگادرو 6.022X 10^23 مولکول وجود دارد. بنابراین میتوان گفت:
The number of molecules of Cl2 =7.1 gr Cl2 × 1mol Cl2/71gr Cl2 × 6.023×10^23 molecules Cl2/mol
سلام برای محاسبه امونیم فوسفید چند اتم دارد؟ ی نفر گفت جواب میشه ۱۶ ، چطوري بدست میاد؟
سلام برای محاسبه امونیم فوسفید چند اتم دارد؟ ی نفر گفت جواب میشه ۱۶ ، چطوري بدست میاد؟
با سلام
فرمول Ammonium phosphide به صورت P(NH4)3 است و ۱۶ اتم دارد.
درسته، اما بدست آوردن اتم چگونه بوجود می آید؟ چطوری شده ۱۶ اتم؟
Ammonium Sulfide atoms =1P+3N+12H
الان متوجه شدم ،خیلی ممنونم از شما.🌷
الان متوجه شدم. خیلی ممنون🌷
سلام چند مول هوا درشرایط متعارف در اتاقی به ابعاد 4*3*3وجود دارد. تعداد مولکولها هوا را محاسبه کنید(R=8.314)
با سلام
از رابطه PV=nRT بایستی استفاده کنید. P=10^5 pa،V=3*3*4، T=273K،R=8.314 را در رابطه فوق جایگذاری کنید تا تعداد مول هوا به دست آید. سپس با توجه به اینکه در هر مول گاز برابر تعداد عدد آووگادرو مولکول گاز وجود دارد، با استفاده از یک تناسب ساده میتوانید تعداد مولکولهای موجود در مول حاصل از مرحله قبل را به دست آورید.
سلام این میله اگه جواب هید با راحل ممنون میشم چند مول در اتاقی در شرایط متعارف به ابعاد 4*3*3وجود داد تعداد مولوکلهای هوا را حساب کنید (R=8.314)
با سلام
از رابطه PV=nRT بایستی استفاده کنید. P=10^5 pa،V=3*3*4، T=273K،R=8.314 را در رابطه فوق جایگذاری کنید تا تعداد مول هوا به دست آید. سپس با توجه به اینکه در هر مول گاز برابر تعداد عدد آووگادرو مولکول گاز وجود دارد، با استفاده از یک تناسب ساده میتوانید تعداد مولکولهای موجود در مول حاصل از مرحله قبل را به دست آورید.
سلام .جند مول در اتاقی به ابعاد 4*3*3وجودادرد تعداد مولکولها را محاسبه کنید
با سلام
از رابطه PV=nRT بایستی استفاده کنید. P=10^5 pa،V=3*3*4، T=273K،R=8.314 را در رابطه فوق جایگذاری کنید تا تعداد مول هوا به دست آید. سپس با توجه به اینکه در هر مول گاز برابر تعداد عدد آووگادرو مولکول گاز وجود دارد، با استفاده از یک تناسب ساده میتوانید تعداد مولکولهای موجود در مول حاصل از مرحله قبل را به دست آورید.
در 75 گرم H2SO4 چند اتم و چند مولکول وجود دارد؟ مگر تعداد ذرات اتم و مولکول فرمول جداگانه دارد؟
با سلام. اگر 75 گرم را تقسیم بر وزن مولکولی H2SO4 کنید، تعداد مول H2SO4 به دست میآید. سپس با توجه به اینکه در هر مول از H2SO4 به تعداد عددآووگادرو مولکول وجود دارد، با استفاده از تناسب تعداد مولکولهای مدنظر حاصل میشود. برای به دست آوردن تعداد اتمها نیز در نظر داشته باشید که هر مول از مولکول H2SO4، شامل 2 مول اتم هیدورژن، 1 مول اتم گوگرد و 4 مول اتم اکسیژن است.
سلام وقت بخیر میشه این مسئله رو با راه حل واسم توضیح بدین ممنون میشم
– جرم 10²⁰×3 مولکول O2 و مول O2 چقدر است؟ و اگر توان 10 منفی باشه چطوری میشه؟
سلام. وقت شما هم بخیر
به خاطر داشته باشید که هر مول از O2 دارای 10²3×6.022 (عدد آووگادرو) مولکول است و جرم آنها برابر وزن مولکولی O2 (32 g/mol) می باشد.
با درک این موضوع ، با یک تناسب میتوانید جرم و تعداد مول ( 10²⁰×3 مولکول O2 ) را محاسبه کنید.
الان ساعت ۵ صبح روز قبل نهایی شیمی دهم هستش و ۴ ساعت دیگه نهایی دارم بهترین اموزش ممکن بود خدا هر چی میخوایید رو بهتون بده<
سلام. ممنون که نظرتون رو به اشتراک گذاشتید. موفق باشید.
سلام و عرض ادب
لطفا نحوه تهیه ۹ میلی لیتر محلول ۱۵۰ میلی مولار Nacl را توضیح بدین. ممنون از لطف شما
با سلام
9*10^-3 ml * 150*10^-3 mol/lit *58.44 gr NaCl/mol NaCl = 0.078 gr Nacl
این مقدار از نمک را در آب حل کرده و به حجم 9 سی سی میرسانیم.
سلام وقت بخیر من میخواهم محلول 0.5مولار پودر آلوئه ورا و آب مقطر درست کنم اگر حجم محلولم 10میلی لیتر باشد چند گرم پودر آلوئه ورا باید اضافه کنم؟
سلام.
وزن مولکولی Aloevera برابر 267.279 است.
بنابراین مقدار آلوئه ورای مورد نیاز شما برابر خواهد بود با :
0.01 lit*0.5 mol/lit * 267.279 gr/mol = 1.336 gr
سلام وقتتون بخیر
ببخشید من یه سوال دارم
ما دارویی دارم با غلظت ۵/۲ میکروگرم به روی میلی لیتر آیا میتوان این عدد را به میکرومولار تبدیل کرد؟؟
من واقعا گیج شدم ممنون میشم راهنمایین کنید
با سلام و احترام
بله. مولار در واقع بیان غلظت به صورت مول بر لیتر است. با تبدیل گرم به مول و میلی لیتر به لیتر میتوانید تبدیل بین این واحدها را انجام دهید.
موفق باشید.