ساختارهای لوئیس (lewis structure) ساده ترین مدل برای برای نشان دادن چگونگی قرارگرفتن پیوندها و جفت های الکترون ها در یک ترکیب است و نقطه شروع برای برای درک ساختار و شکل مولکولی محسوب میشود. “چگونگی رسم ساختار لوییس” یکی از مباحثی است که دانش آموزان برای موفقیت در آزمون های شیمی و کنکور حتما بایستی به آن مسلط باشند. اگر علاقه مند به رسم ساختارهای مولکولی هستید با ما همراه باشید تا چگونگی رسم ساختارهای لوییس را بررسی کنیم. اگر علاقه مند به یادگیری ساختار لوویس و نحوه رسم آن هستید با ما همراه باشید تا چگونگی رسم ساختارهای لوییس را بررسی کنیم.
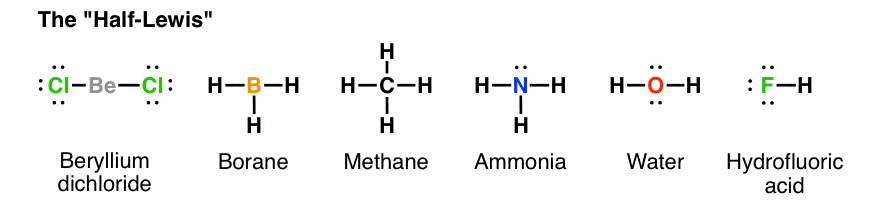
دانشجویان شیمی اغلب در رسم ساختارهای شیمیایی مولکول ها دچار سردرگمی میشوند، اما با پیروی از یک روند صحیح به راحتی میتوان ساختارهای لوئیس را ترسیم و ساختار مولکولها را پیش بینی کرد. روشهای مختلفی برای رسم ساختارهای لوئیس وجود دارد که همگی از استراتژی کلتر (Kelter strategy) برای ترسیم ساختارهای لوئیس برای مولکول ها پیروی میکنند. شما در ادامه با روش بسیار آسانی آشنا میشوید که با طی کردن مراحل آن به سادگی میتوانید ساختارهای لوییس را ترسیم کنید.
مرحله 1: تعداد کل الکترونهای ظرفیت را پیدا کنید
در این مرحله تعداد کل الکترونهای ظرفیت همه اتمهای تشکیل دهنده مولکول را جمع کنید.
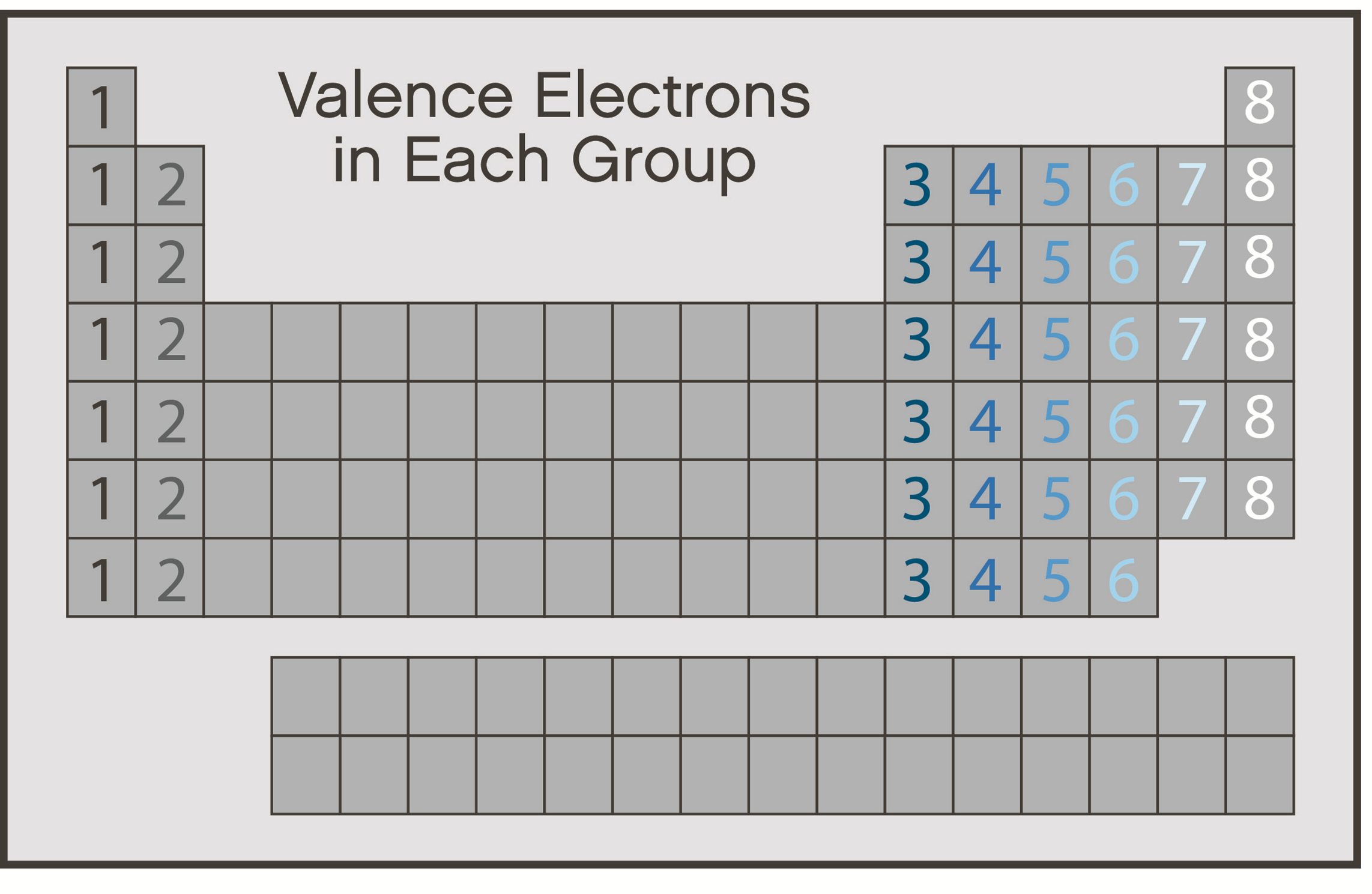
مرحله 2: تعداد الکترون های مورد نیاز برای “خوشحال کردن” اتم ها را پیدا کنید
یک اتم هنگامی که لایه ظرفیت آن پر شود، “خوشحال” تلقی می شود. عناصر تا دوره چهار در جدول تناوبی برای پر کردن لایه ظرفیت خارجی خود به هشت الکترون نیاز دارند. این خاصیت اغلب به عنوان قانون هشتایی (octet rule) شناخته می شود.

مرحله 3: تعداد پیوندهای موجود در مولکول را تعیین کنید
پیوندهای کووالانسی وقتی تشکیل می شوند که از هر اتم یک الکترون به اشتراک گذاشته شده و یک جفت الکترون تشکیل گردد. در مراحل قبلی مرحله 2 بیان کننده تعداد الکترون مورد نیاز برای رسیدن به هشت تایی و مرحله 1 تعداد الکترون های شماست. با کم کردن عدد بدست آمده مرحله 1 از عدد مرحله 2 تعداد الکترون های مورد نیاز برای تکمیل هشتایی اتمها به دست میآید. هر پیوند برای تشکیل به دو الکترون نیاز دارد و تعداد پیوندها نصف تعداد الکترون های مورد نیاز است. به عبارت دیگر میتوان گفت:
مرحله 4: اتم مرکزی را انتخاب کنید
اتم مرکزی یک مولکول معمولاً کمترین الکترونگاتیوی را دارد و یا دارای بالاترین ظرفیت است. برای یافتن الکترونگاتیوترین اتم از روند جدول تناوبی و یا از جداول الکترونگاتیوی استفاده کنید. در جدول تناوبی در یک گروه از بالا به پایین الکترونگاتیوی کاهش در طول یک دوره از چپ به راست افزایش می یابد. همچنین اتم های هیدروژن و هالوژن تمایل دارند در اطراف مولکول ظاهر شوند و به ندرت اتم مرکزی هستند.

مرحله 5: ساختار اولیه مولکول را رسم کنید
اتم ها را با یک خط مستقیم که نشان دهنده پیوند بین دو اتم است ، به اتم مرکزی متصل کنید. اتم مرکزی معمولا میتواند به بیشتر از چهار اتم دیگر متصل شود.
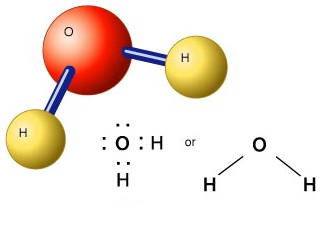
مرحله 6: الکترونها را اطراف اتم ها قرار دهید
هشت تایی اطراف هر یک از اتم های اطراف اتم مرکزی را کامل کنید. اگر الکترون کافی برای تکمیل هشتایی وجود نداشته باشید، احتمالا ساختار رسم شده در مرحله 5 نادرست است و بایستی چیدمان دیگری را امتحان کنید. در ابتدا ممکن است نیاز به آزمایش و خطا داشته باشید ولی با تمرین بیشتر به آسانی میتوانید ساختارهای اولیه مولکولها را پیش بینی کنید.
مرحله 7: الکترونهای باقیمانده را در اطراف اتم مرکزی قرار دهید
هشتایی را برای اتم مرکزی با الکترونهای باقیمانده کامل کنید. اگر از مرحله 3 پیوندی باقی مانده است ، پیوندهای دوگانه با جفت الکترونهای تنها در اتمهای اطراف ایجاد کنید. یک پیوند دوگانه با دو خط صاف نشان بین یک جفت اتم نشان داده میشود. اگر بیش از هشت الکترون بر روی اتم مرکزی وجود داشته باشد و اتم از موارد استثنا در قاعده هشت تایی نباشد ، ممکن است تعداد اتم های ظرفیت در مرحله 1 به اشتباه شمرده شده باشد.
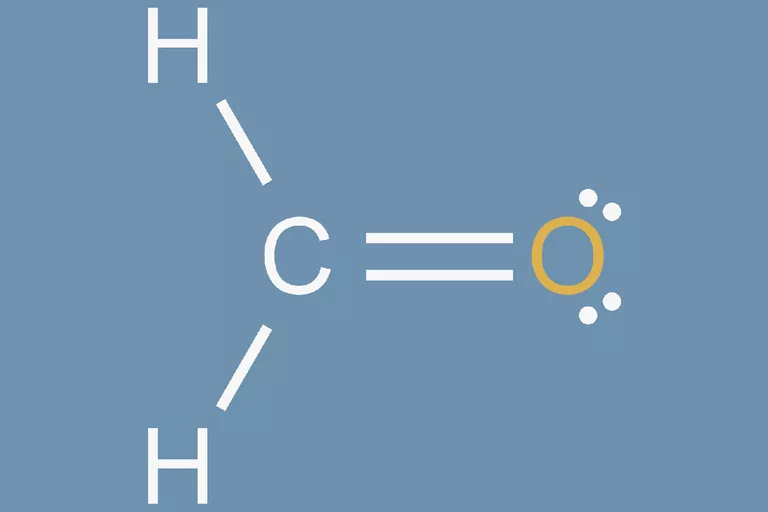
چگونه ساختار لوویس فرمالدهید را رسم کنیم؟
فرمالدئید یک مولکول آلی سمی با فرمول مولکولی CH2O است. برای رسم ساختار لوویس آن مراحل ذکر شده در بالا را به ترتیب انجام دهید:
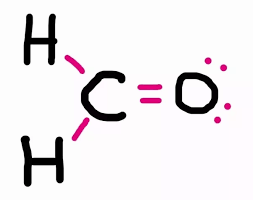
1. تعداد کل الکترونهای ظرفیت را پیدا کنید.
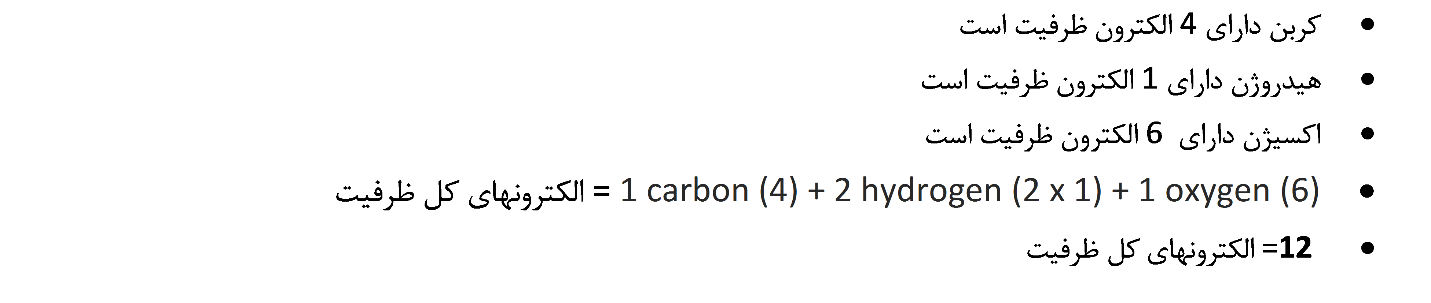
2. تعداد الکترون های مورد نیاز برای رسیدن به هشتایی یا “خوشحال کردن” اتم ها را پیدا کنید
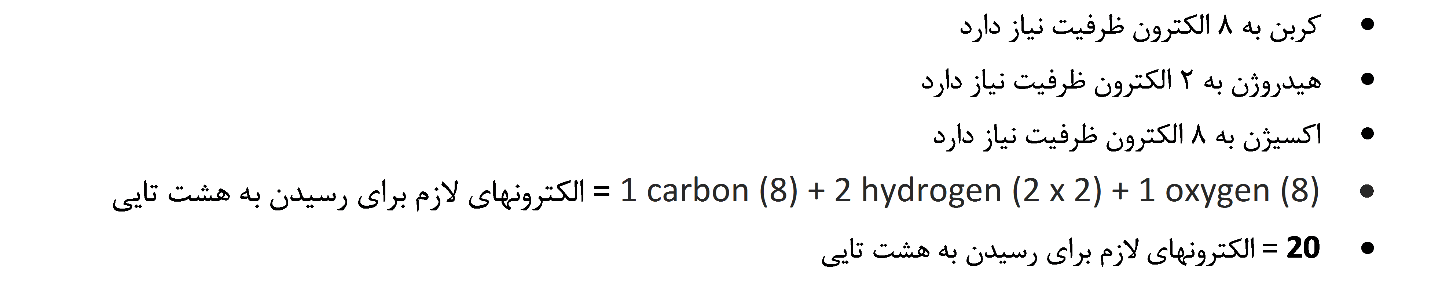
3. تعداد پیوندهای مولکول را تعیین کنید
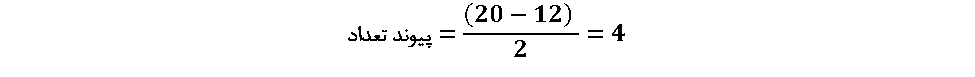
4. یک اتم مرکزی انتخاب کنید
هیدروژن کمترین الکترونگاتیوی را دارد اما هیدروژن به ندرت اتم مرکزی یک مولکول است. کمترین الکترونگاتیوی بعدی متعلق به کربن است. بنابرای کربن به عنوان اتم مرکزی در نظر گرفته میشود. 
5. اسکلت مولکول را رسم کنید
سه اتم دیگر را به اتمهای کربن مرکزی متصل کنید. از آنجا که 4 پیوند در مولکول وجود دارد ، یکی از سه اتم با پیوند دوگانه پیوند خواهد داشت. اکسیژن تنها انتخاب در این مورد است زیرا هیدروژن فقط یک الکترون برای تقسیم دارد.
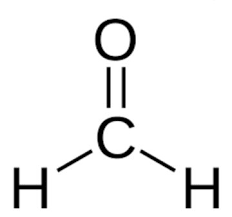
6. الکترونها را در اطراف اتمهای اطراف اتم مرکزی قرار دهید
در ساختار فرمالدهید به ط.ورکل 12 الکترون ظرفیت وجود دارد. هشت عدد از این الکترونها به صورت پیوندی بسته شده اند و چهار الکترون باقیمانده هشتایی اتم اکسیژن را کامل می کنند. با قرار دادن الکترونها اطراف اتم اکسیژن ساختار نهایی زیر برای مولکول حاصل میشود. همانطوری که مشاهده میکنید هر اتم در مولکول یک لایه کامل و پر از الکترون دارد و ساختار کامل است.
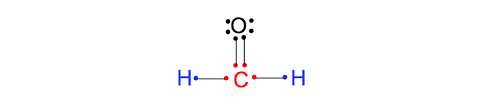
مقایسه ساختارهای لوئیس با ساختار واقعی مولکولها
اگرچه ساختارهای لوئیس بسیار ارزشمند و مفید هستند ولی استثناهای زیادی برای این قوانین در دنیای واقعی وجود دارد. اتم ها به دنبال پر کردن یا نیمه پر شدن لایه ظرفیت خود هستند. با این حال ، اتم ها می توانند مولکول هایی تشکیل دهند که از نظر تئوری پایدار نیستند. همچنین تعداد الکترونهای ظرفیت مخصوصا برای اعداد اتمی بالا می تواند بیش از هشت باشد. ساختارهای لوئیس برای عناصر سبک مفید است اما برای فلزات عاصر واسطه مانند لانتانیدها و اکتینیدها کمتر مفید است. در واقع ساختارهای لوئیس ابزاری ارزشمند برای یادگیری و پیش بینی رفتار اتم ها در مولکول ها هستند اما نمیتوانند فعالیت واقعی الکترون ها را نمایش دهند.
چگونه میتوان اطلاعات آنلاین در مورد ساختار لوویس بهدست آورد؟
- سایت chem.libretexts.org اطلاعات بسیار خوبی در مورد کلیات و نحوه ترسیم ساختارهای لوویس در اختیارشما قرار میدهد.
- شما می توانید ساختار ترکیب مورد نظر را در سایت web.chemdoodle.com رسم کنید و ساختار لوویس آن را مشاهده کنید.
https://web.chemdoodle.com/demos/lewis-dot-structures#customise-template
- با وارد کردن فرمول شیمیایی ترکیب مورد نظر در سایت wolframalpha.com میتوانید ساختار لوویس را همراه با نام ترکیب مشاهده کنید.
https://www.wolframalpha.com/widgets/view.jsp?id=c11e9ad0ab00998884f0733c8f62c07d
نتیجه گیری:
- ساختار لوئیس پیوندهای کووالانسی و جفت الکترونهای آزاد یک مولکول را نشان می دهد.
- قانون اکتت اساس رسم ساختار لوییس را تشکیل میدهد.
- ساختارهای لوئیس برای توصیف پیوند شیمیایی مفید هستند، اما دارای استثناء است و نمیتواند برای بررسی ساختارهای آروماتیک مورد استفاده قرار گیرد.
منابع
- Lewis, G.N. “The Atom and the Molecule,” Journal of the American Chemical Society
- Weinhold, Frank and Landis, Clark R. “Valency and Bonding: A Natural Bond Orbital Donor-Acceptor Perspective.” Cambridge University Press


درود
عالی بود خسته نباشید، سورت شده و مرتب!
ممنونم که نظرتون رو به اشتراک گذاشتید. موفق باشید.