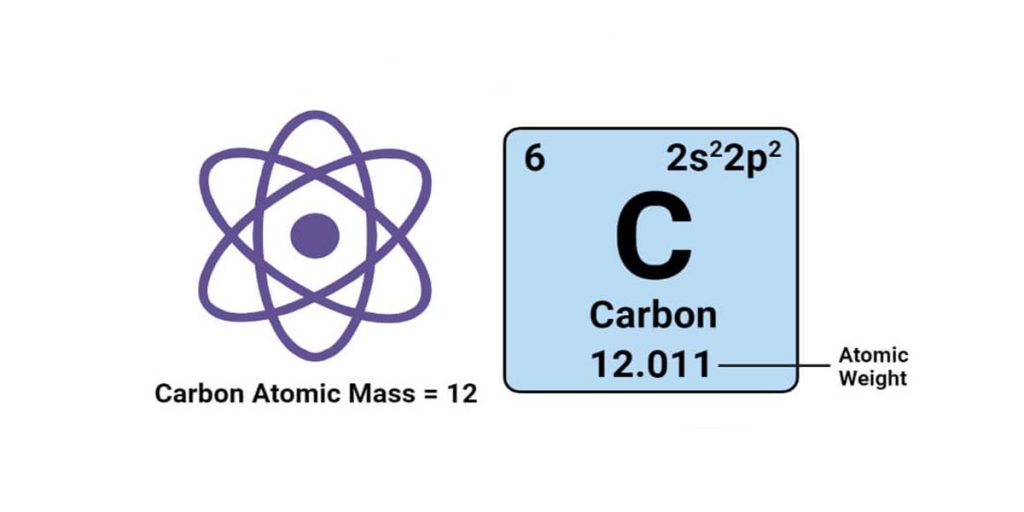
وزن اتمی و جرم اتمی دو مفهوم مهم در شیمی و فیزیک هستند. بسیاری از افراد این اصطلاحات را به جای یکدیگر استفاده می کنند، اما در واقع آنها معنی یکسان ندارند. اگر به تفاوت وزن اتمی و جرم اتمی نگاهی بیندازید درک میکنید که چرا اکثر افراد این تفاوت را درک نمیکنند و یا اهمیتی برای این تفاوت قائل نیستند. با ما همراه باشید تا
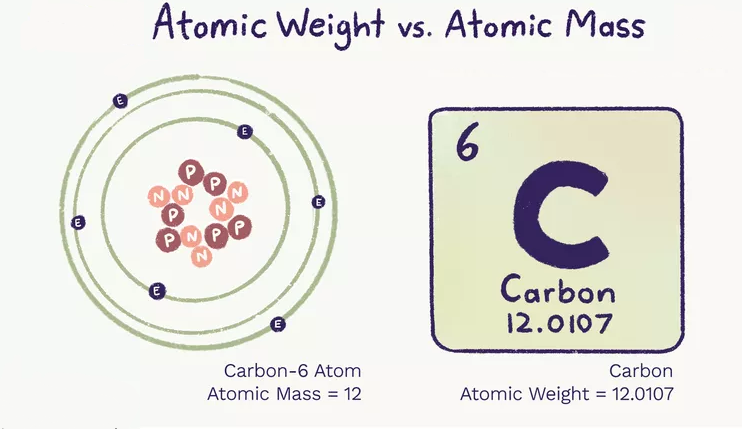
- جرم اتمی (ma) جرم یک اتم است. یک اتم منفرد دارای تعداد مشخصی پروتون و نوترون است و جرم اتم به صورت مجموع تعداد پروتون ها و نوترون های اتم محاسبه میشود. جرم اتمی ثابت بوده و تغییر نمیکند. جرم الکترون هم آنقدر کم است که در محاسبه جرم شمارش نمی شود.
- وزن اتمی میانگین وزن متوسط تمام اتمهای یک عنصر بر اساس فراوانی ایزوتوپهای آن است. وزن اتمی می تواند تغییر کند و به دانش ما از میزان فراونی ایزوتوپ یک عنصر بستگی دارد.
- جرم اتمی و وزن اتمی بر اساس واحد جرم اتمی (amu) هستند که معادل 12/1 جرم یک اتم کربن 12 در حالت پایه است.
آیا جرم اتمی و وزن اتمی می توانند یکسان باشند؟

اگر عنصری فقط یک ایزوتوپ داشته باشد جرم اتمی و وزن اتمی آن یکسان خواهد بود. در این حالت، شما میتوانید در محاسبات خود از جرم اتمی (atomic mass) به جای وزن اتمی (atomic weight) که در جدول تناوبی آورده شده استفاده کنید.
مقایسه وزن و جرم:
جرم واحد اندازه گیری مقدار ماده است، در حالی که وزن اندازه گیری چگونگی عملکرد جرم در میدان گرانشی است. ما در زمین به دلیل جاذبه زمین در معرض شتاب نسبتاً ثابت هستیم و تعاریف ما از جرم تقریباً با توجه به گرانش زمین صورت گرفته است و اگر جرم 1 کیلویی در زمین را به ماه ببرید، وزن آن کمتر خواهد شد.
زمانی که اصطلاح وزن اتمی در سال 1808 ابداع شد ، ایزوتوپ ها ناشناخته بودند و گرانش زمین یک امر عادی محسوب میشد. تفاوت بین وزن اتمی و جرم اتمی زمانی مشخص شد که F.W. Aston ، مخترع طیف سنج جرمی (سال 1927) از دستگاه جدید خود برای مطالعه نئون استفاده کرد. در آن زمان اعتقاد بر این بود که وزن اتمی نئون 20.2 amu است ، با این وجود آستون دو قله را در جرم های نسبی 20.0 amu و 22.0 amu در طیف جرمی نئون مشاهده کرد. آستون در واقع دو نوع اتم نئون را در نمونه خود پیشنهاد داده است: 90٪ از اتم ها دارای جرم 20 amu و 10٪ با جرم 22 amu بودند. این نسبت به طور متوسط وزنی برابر با 20.2 amu دارد. آستون گونههای مختلف اتم های نئون را “ایزوتوپ” نامید. همچنین فردریک سودی در سال 1911 اصطلاح ایزوتوپ ها را برای توصیف اتم هایی که ماهیت متفاوتی داشته ولی در جدول تناوبی موقعیت یکسانی دارندارائه کرده است. اگرچه “وزن اتمی” توصیف خوبی نیست و امروزه از اصطلاح صحیح “جرم اتمی نسبی” به جای “وزن اتمی” استفاده میشود.